Pesquisa Clínica no Brasil mudou
- Flavia Pinheiro Zanotto

- 2 de nov. de 2025
- 3 min de leitura
💊 Já sabem do Novo Marco Legal para estudos com pesquisas clínicas no Brasil?
Vejam as principais mudanças dentre outras.
1. Novo Marco Legal: a Lei nº 14.874/2024 substitui normas dispersas anteriormente
🔸 Antes:
A base legal da pesquisa com seres humanos era a Resolução CNS nº 466/2012, um ato administrativo, sem força de lei.
Não havia lei federal específica, o que gerava insegurança jurídica, especialmente para patrocinadores e centros internacionais.
🔸 Agora:
A Lei nº 14.874/2024 cria um marco legal completo e hierarquicamente superior, reconhecendo oficialmente:
O Sistema Nacional de Ética em Pesquisa;
O papel da CONEP como órgão central, agora instituído por lei;
Direitos, deveres e garantias aos participantes de pesquisa.
🔹 Impacto prático:
👉 Dá segurança jurídica, reduz interpretações divergentes e atrai mais ensaios clínicos internacionais para o Brasil.
2. Integração Ética e Regulatória
🔸 Antes:
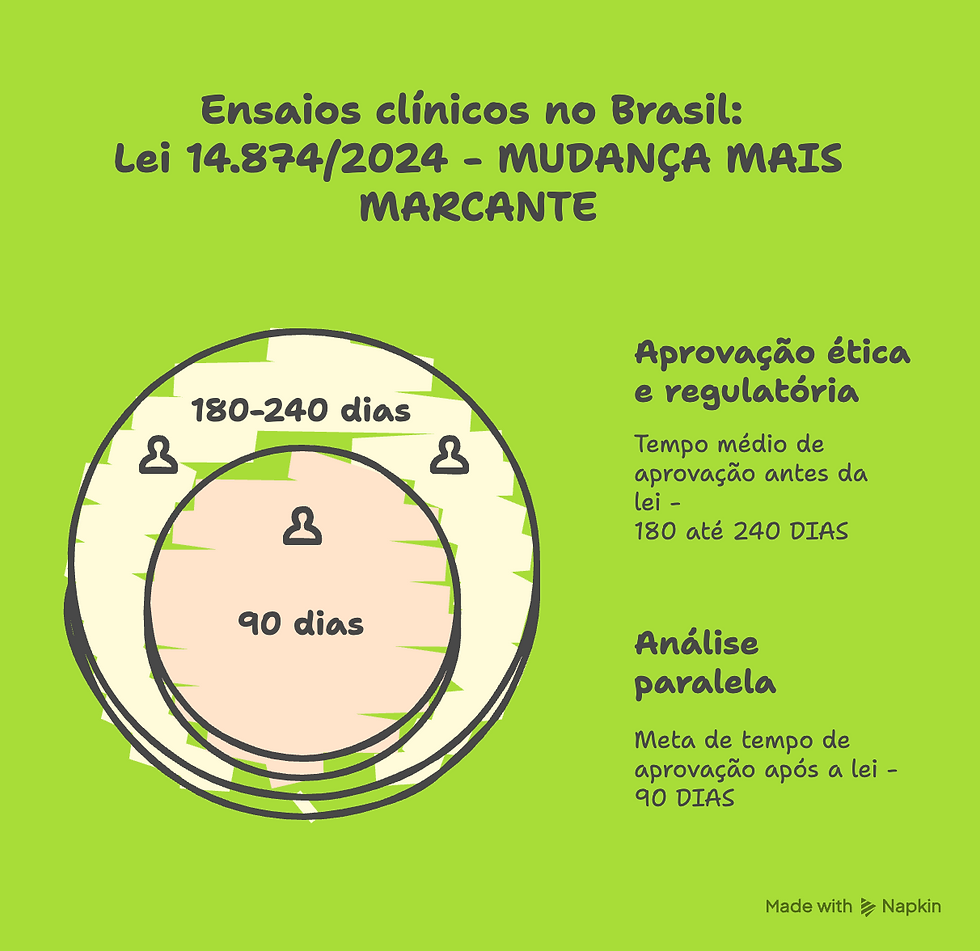
O fluxo era sequencial: primeiro aprovação ética (CEP/CONEP), depois regulatória (ANVISA).
Isso gerava longas filas — em média 180 a 240 dias para aprovação de um ensaio clínico completo.
🔸 Agora:
A Lei 14.874/2024 permite análise paralela: a ANVISA e a CONEP podem avaliar ao mesmo tempo.
A RDC 945/2024 confirma esse fluxo, otimizando o tempo.
🔹 Impacto prático:
👉 Redução drástica do tempo de aprovação (meta de 90 dias úteis).👉 Sincronia entre ética e regulação, com comunicação formal entre as duas instâncias.
3. Prazos e previsibilidade
🔸 Antes:
Nenhuma norma definia prazo máximo para análise de ensaios clínicos.
ANVISA e CEPs podiam levar meses (ou até mais de um ano) para responder.
🔸 Agora:
A RDC 945/2024 fixa prazo de até 90 dias úteis para análise primária pela ANVISA.
Após esse prazo, se não houver manifestação e houver aprovação ética, o estudo pode iniciar automaticamente (silêncio positivo).
🔹 Impacto prático:
👉 Previsibilidade e eficiência.👉 Incentivo a novos investimentos em P&D no país.
4. Reconhecimento de autoridades estrangeiras (reliance ou “análise otimizada”)
🔸 Antes:
O Brasil revisava integralmente os dossiês clínicos, mesmo que já aprovados por agências como FDA ou EMA.
🔸 Agora:
A RDC 945/2024 cria o procedimento otimizado de análise (reliance):
ANVISA pode reconhecer a avaliação de autoridades regulatórias estrangeiras equivalentes (AREEs);
Isso acelera a aprovação nacional.
🔹 Impacto prático:
👉 Reduz redundâncias.👉 Torna o Brasil competitivo frente a EUA e Europa em tempo de aprovação de estudos multinacionais.
5. Direitos e segurança dos participantes
🔸 Antes:
A proteção dos participantes era garantida apenas por resoluções (CNS 466/12 e 510/16), sem penalidades legais diretas.
🔸 Agora:
A Lei 14.874/2024:
Torna obrigatório o seguro para cobrir danos;
Define responsabilidade solidária entre pesquisador e patrocinador;
Prevê compensação financeira e penalidades legais (arts. 22–27).
🔹 Impacto prático:
👉 Fortalece a ética e proteção do voluntário.👉 Dá clareza sobre responsabilidades e indenizações.
6. Ampliação do escopo da ANVISA
🔸 Antes:
RDC 9/2015 tratava apenas de medicamentos sintéticos e biológicos.
🔸 Agora:
RDC 945/2024 inclui também fitoterápicos, radiofármacos, biossimilares e produtos de terapia avançada.
🔹 Impacto prático:
👉 Regulamenta novas terapias e amplia o campo de inovação nacional.
7. Transparência e registro público
🔸 Antes:
Registro em bases públicas (como o ReBEC) era recomendado, mas não obrigatório.
🔸 Agora:
Registro obrigatório em plataforma pública nacional (ReBEC) ou internacional (ClinicalTrials.gov, EudraCT, etc.).
🔹 Impacto prático:
👉 Fortalece a transparência, rastreabilidade e acesso público aos resultados de pesquisa.




Comentários